Из чего состоят заменимые и незаменимые аминокислоты
Аминокислоты играют важную роль — принимают участие в биосинтезе белка. Расщепление белка на аминокислоты происходит в желудочно-кишечном тракте человека. Сколько существует аминокислот? Сегодня известно около двухсот пептидов, но всего 20 аминокислот принимают участие в строительстве биологического организма. Поэтому если перед вами стоит вопрос, как запомнить аминокислоты, не стоит паниковать: нужно запомнить всего 20.
Есть заменимые и незаменимые аминокислоты. Также некоторые выделяют условно заменимые аминокислоты.
Заменимые аминокислоты
Определение 2
Заменимые аминокислоты — те аминокислоты, которые попадают в организм человека вместе с продуктами питания.
В самом человеке они тоже могут производиться — из прочих веществ.
Среди таких аминокислот выделяются:
- аланин. Это мономер белков. Он принимает участие в процессе глюкогенеза, становясь глюкозой в человеческой печени. Отвечает за регулирование метаболических процессов;
- аргинин. Синтезируется только в организме взрослых людей — в организме детей образоваться не может. Играет важную роль, к примеру, в системе синтеза гормона роста. Единственная аминокислота, переносящая азот. С ее помощью увеличивается мышечная масса и снижается жировая;
- аспарагин. Является пептидом азотного обмена. Действуя с ферментами, отщепляет аммониак и преобразуется в аспарагиновую кислоту;
- аспарагиновая кислота. Отвечает за образование иммуноглобулинов и деактивацию аммиака. Помогает восстановить баланс в работе сердечного цикла и нервной системы;
- гистидин. Применяют в лечении кишечных заболеваний и в качестве профилактики СПИДа. Уменьшает негативное влияние на человеческий организм стрессовых факторов;
- глицин. Нейромедиатор. Успокаивает;
- глутамин. Составляющая гемоглобина. Отвечает за стимуляцию метаболизма в ЦНС;
- глютаминовая кислота. Отвечает за регуляцию периферической нервной системы;
- пролин. Есть в составе протеинов. Например, в коллагене и эластине;
- серин. Аминокислота, которую можно найти в нейронах головного мозга. Облегчает выработку и высвобождение энергии. Возникает из глицина;
- тирозин. Из этой аминокислоты состоят, в том числе, растительные и животные ткани. В некоторых случаях восстанавливаются из фенилаланина;
- цистеин. Компонент кератина. Принадлежит к антиоксидантам. В отдельных случаях воспроизводится из серина.
Замечание 1
Описанные функции кислот не являются полными и могут быть продолжены.
Незаменимые аминокислоты
Определение 3
Незаменимые аминокислоты — те, синтез которых человеческим организмом не предусмотрен.
Содержатся в отдельных продуктах и поступают в организм с приемом пищи.
В список аминокислот, которые в организме не вырабатываются, входят:
- валин. Повышает координацию функционирования мышц, обеспечивает устойчивость организма к изменениям температуры;
- изолейцин. Его еще называют естественным анаболиком. Отвечает за насыщение мышц необходимой энергией;
- лейцин. Отвечает за регуляцию всех процессов метаболизма. Важный участник процесса построения белковой структуры. Вместе с двумя описанными выше аминокислотами составляет комплекс BCAA (который отвечает за построение мышечной массы). Эта аминокислота, и комплекс в целом, важна для людей, занимающихся спортом. Она помогает увеличить мышечную массу, понизить уровень развития ПЖК (подкожно-жировая клетчатка), поддерживать гомеостаз при больших физнагрузках;
- лизин. Его наличие в организме влияет на улучшение регенерации тканей, выработку гормонов, антител и ферментов. Также немаловажную роль эта аминокислота играет в укреплении сосудов. Находится в составе коллагена;
- метионин. Принимает участи в синтезе холина. Сокращает количество жира в печени;
- треонин. Отвечает за укрепление сухожилий и эмали зубов;
- триптофан. Помогает в регуляции эмоционального состояния, лечении психических расстройств личности;
- фениалалнин. Принимает участие в регуляции деятельности кожных покровов путем снижения их пигментации. Восстанавливает водно-солевой баланс верхних слоев кожи.
Аспарагин
Пытаясь ответить на вопрос: «Сколько аминокислот входит в состав белка?», ученые в первую очередь открыли именно аспарагин. Было это в далеком 1806 году. Данная кислота принимает участие в улучшении работы нервной системы. Она содержится во всех животных белках, а также орехах, картофеле и злаках.
Изолейцин
Эта кислота ускоряет выработку энергии, поэтому ее так любят спортсмены. После изнурительных занятий она помогает быстрому восстановлению мышечных волокон. Изолейцин снимает так называемую крепатуру, принимает участие в образовании гемоглобина и регулирует количество сахара. Больше всего изолейцина содержится в мясе, рыбе, яйцах, орехах, горохе и сое.

Сколько аминокислот входит в состав белка
Структура белков довольно сложна, рассмотрим ее на базовом уровне. Мы знаем, что аминокарбоновые кислоты являются своеобразными строительными блоками в здании под названием белок и в мегаполисе под названием человек. Однако не во всех белках есть именно те элементы, которые нам нужны. Если взглянуть на белок под микроскопом, можно увидеть цепочку из аминокислот, которые соединяются пептидными связями. Грубо говоря, звенья этой цепочки служат в нашем организме ремонтным и строительным материалом.
Удивительно, но было время, когда ученые не знали о том, сколько различных аминокислот входит в состав белков. Большинство из них были открыты в 19, а остальные в 20-м веке. Ученым понадобилось 119 лет, чтобы окончательно ответить на вопрос: «Сколько аминокислот входит в состав белка?» Строение каждой из них изучалось еще дольше.
На сегодняшний день известно, что для нормальной жизнедеятельности человеческого организма необходимо 20 протеиногенных аминокарбоновых кислот. Эту двадцатку часто называют мажорными кислотами. С точки зрения химии, их классифицируют по множеству признаков. Но простым обывателям наиболее близка классификация по способности кислот синтезироваться в нашем организме. По этому признаку аминокислоты бывают заменимыми и незаменимыми.

В этой классификации есть некоторые недостатки. К примеру, аргинин в некоторых физиологических состояниях считается незаменимым, но он может синтезироваться организмом. А гистидин восполняется в столь малых количествах, что его все-таки необходимо принимать с пищей.
Теперь, когда мы знаем, сколько видов аминокислот входит в состав белков, рассмотрим подробнее оба вида.
Лизин
Данная аминокислота играет важную роль в работе иммунной системы. Ее главная задача – синтез антител, которые защищают наш организм от воздействия вирусов и аллергенов. Кроме того, лизин регулирует процесс обновления костной ткани и коллагена, а также гормоны роста. Эту органическую кислоту можно найти в таких продуктах питания, как: яйца, картофель, красное мясо, рыба и кисломолочные продукты.
Цистеин
Эта аминокислота в организме отвечает за синтез кератина. Без нее не было бы здоровых ногтей, волос и кожи. Находится в таких продуктах, как: мясо, яйца, красный перец, чеснок, лук и брокколи.
Niteworks от HERBALIFE Nutrition
В описанных выше ситуациях на помощь могут прийти специальные добавки, например Niteworks от HERBALIFE Nutrition*. В состав продукта входят аминокислоты, поддерживающие правильную работу сердца и сосудов, повышающие эластичность стенок сосудов. Одна порция напитка, приготовленного с этой пищевой добавкой, способна поддерживать уровень ряда важных аминокислот на нормальном уровне в течение суток*.
Строение аминокислот, физические и химические свойства
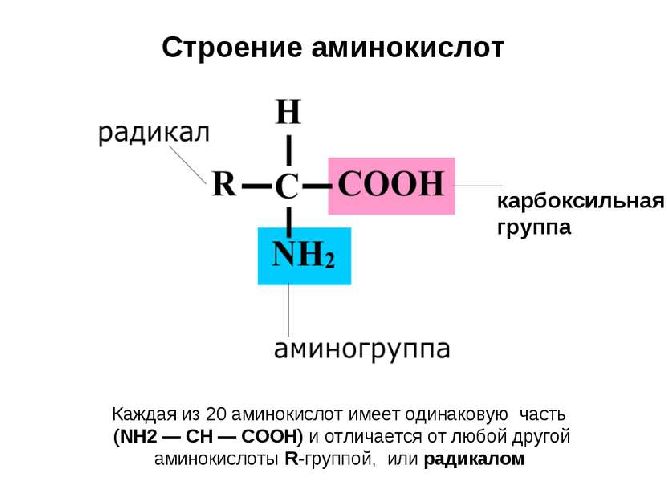
Аминокислоты являются веществами органического происхождения, молекулы которых обладают двумя функциональными группами:
- карбоксильная –COOH;
- аминогруппа −NH2.
Формула 1
Природные аминокислоты имеют следующую общую формулу:
Характерной особенностью природных аминокислот (или α-аминокислот) является наличие в их молекуле COOH– и NH2-групп, связанных с одним и тем же α-углеродным атомом: H2N—(R)C(H)—COOH, где R — углеводородный радикал.
Характерной особенностью природных аминокислот (или α-аминокислот) является наличие в их молекуле COOH– и NH2-групп, связанных с одним и тем же α-углеродным атомом: H2N—(R)C(H)—COOH, где R — углеводородный радикал.
Источник: foxford.ru
Источник: foxford.ru
Отличия между аминокислотами заключаются в структурах боковой группы, или боковой цепи (радикал R), характеризующихся разными размерами, формой, функциональными группами, реакционной способностью. Данные параметры определяют растворимость аминокислот в водной среде и их электрический заряд.
Свойства
Физические свойства:
- Аминокислоты являются твердыми кристаллическими веществами, которые хорошо растворяются в воде.
- Соединения могут обладать сладким вкусом, не иметь вкуса или горчить.
- Все вещества характеризуются температурой плавления более 22°С.
- Водный раствор аминокислот является проводником для электрического тока.
В процессе растворения аминокислот в воде карбоксильная группа отщепляет ион водорода, который обладает способностью присоединиться к аминогруппе. В результате формируется внутренняя соль, или биполярный ион:
Аминокислоты являются амфотерными соединениями, поскольку их молекулы содержат две функциональные группы, отличающиеся характером кислотно-основных свойств:
- аминогруппа с основными свойствами;
- карбоксильная группа с кислотными свойствами.
Водные растворы аминокислот обладают нейтральной, щелочной или кислой средой, исходя из числа функциональных групп. К примеру, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
Свойство
Аминокислоты взаимодействуют с металлами и щелочами, что приводит к образованию соли.
Свойство
Соединения вступают в химическую реакцию с кислотами.
Реакция аминокислоты по аминогруппе с кислотой
Свойство
Аминокислоты способны взаимодействовать с азотистой кислотой с выделением азота.
Взаимодействие глицина и азотистой кислоты:
Свойство
Соединения вступают в химическую реакцию с аминами. В результате такого взаимодействия образуются соли и амиды.
Свойство
Процесс этерификации представляет собой химическую реакцию между аминокислотами и спиртами в присутствии хлороводорода. В результате образуется сложный эфир.
Как и карбоновые кислоты, аминокислоты образуют сложные эфиры при химической реакции со спиртами. Катализаторами при таком взаимодействии являются неорганические кислоты (к примеру, HCl):
В процессе HCl не только выполняет роль катализатора, но и взаимодействует с аминогруппой, образуя соль.
Свойство
Декарбоксилирование осуществляется в процессе нагрева аминокислот с щелочами или просто при нагревании.
Взаимодействие глицина с гидроксидом бария при повышенной температуре:
Разложение глицина в процессе нагрева:
Свойство
При взаимодействии аминокислот друг с другом образуются пептиды. Химическая реакция между двумя α-аминокислотами приводит к образованию дипептида.
Реакция глицина с аланином сопровождается образованием дипептида (глицилаланин):
Фрагменты молекул аминокислот, которые в определенном порядке образуют пептидную цепь, носят названия аминокислотных остатков. В данном случае, связь CO–NH называется пептидной связью.
Пептиды
Вернемся к продукту синтеза двух аминокислот — пептиду — и дадим ему определение.
Пептид — это продукт конденсации двух аминокислот или более, соединенных пептидной связью.
Пептид и белок — это одно и то же? Между ними действительно есть сходство, но есть и различия:
-
Основные различия — это структура и размер. Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
-
Пептиды менее строго определены в структуре, в то время как белки могут принимать сложные конформации.
-
Пептиды делятся на олигопептиды и полипептиды, а белок состоит из нескольких полипептидов.
Тирозин
Отвечает за регулировку артериального давления и аппетит. При недостатке этой кислоты человек страдает быстрой утомляемостью. Чтобы таких проблем не было, нужно есть бананы, семечки, орехи и авокадо.

Глицин
Помогает крови сворачиваться, а глюкозе — перерабатываться в энергию. Встречается в мясе, рыбе, бобовых и молоке.
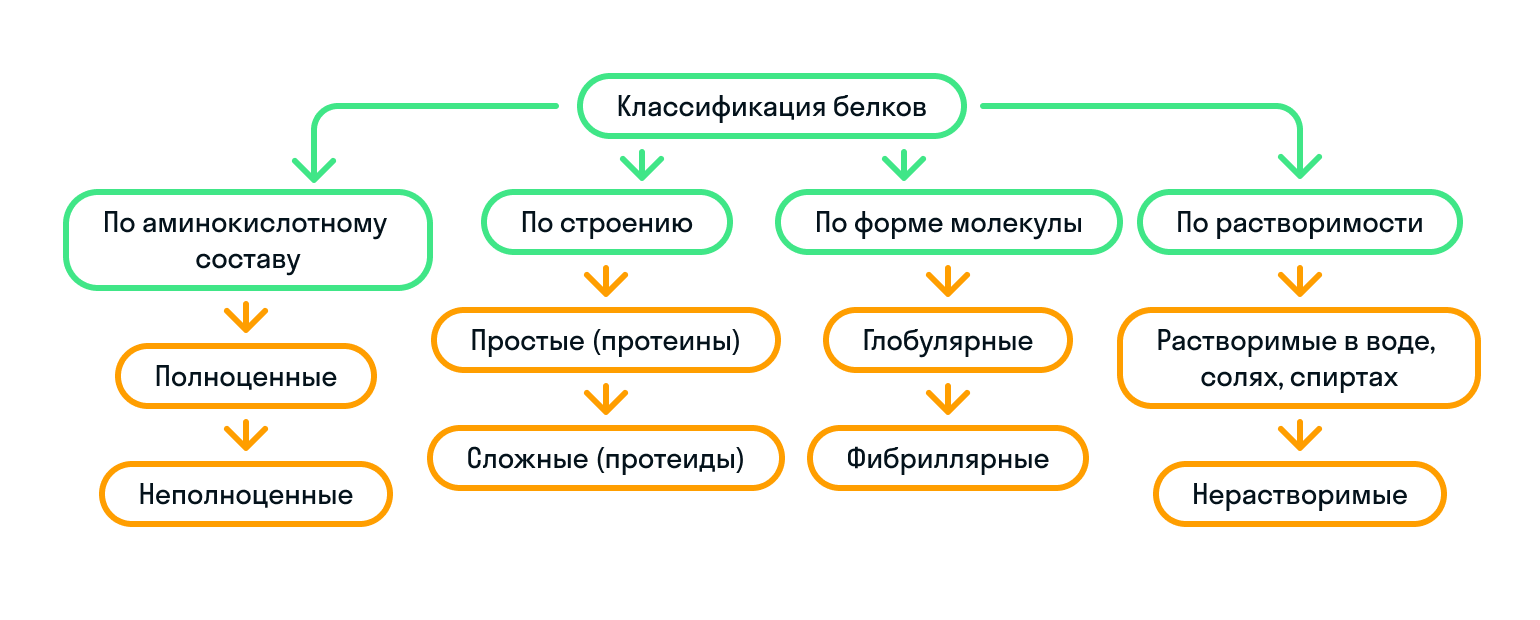
Какие бывают белки
По строению
По строению белки делятся на простые (протеины) и сложные (протеиды):
-
составными частями простых белков являются в большинстве 20 различных остатков α–аминокислот;
-
сложные белки могут содержать ионы металлов или образовывать комплексные соединения с углеводами, липидами и др.
По форме молекулы
По форме молекулы белки подразделяются на глобулярные и фибриллярные:
-
форма молекулы глобулярных белков — глобула (сфера или эллипс). Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
-
форма молекулы фибриллярных белков — фибрилла (нити или волокна). Например, кератин (волосы, ногти, перья), коллаген (мускулы, сухожилия). Эти белки в воде не растворяются.
По аминокислотному составу
Как мы уже знаем, существуют незаменимые аминокислоты. Так вот, исходя из их наличия, белки бывают либо полноценные, либо неполноценные:
-
к полноценным относятся белки животного происхождения, также полноценные белки содержат некоторые растения: картофель, бобовые и другие;
-
к неполноценным относятся желатин и белки преимущественно растительного происхождения.
По растворимости
Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и определяется природой тех групп, которые находятся на поверхности белковой молекулы.
Так, существуют белки (глобулины), которые растворяются только в растворах солей и не растворяются в чистой воде, а противоположные им альбумины хорошо растворимы в чистой воде.
К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (шелк, паутина).
Чтобы запомнить классификацию белков было проще, показали ее на картинке:
Ферменты
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).
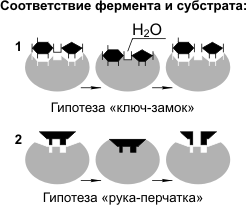
Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Э. Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с «ключом», фермент — с «замком».
Д. Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия.
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.

Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.

Химические формулы аминокислот
Условная формула аминокислоты в общем виде:
Вот как выглядит структурная формула аминокислот:
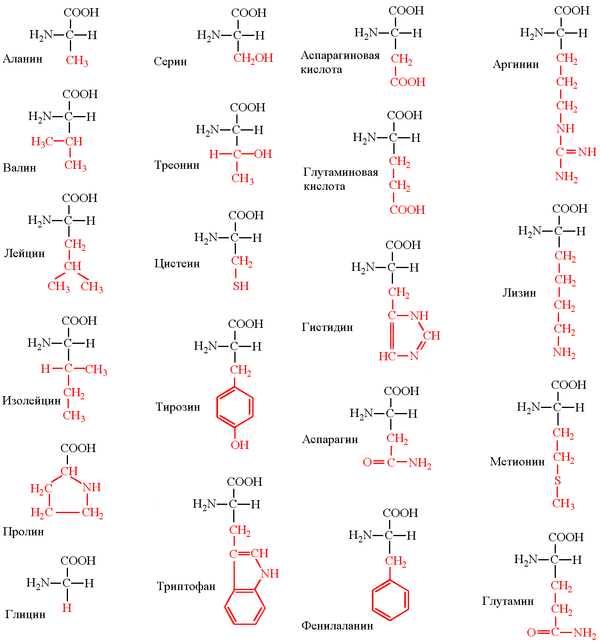
Ниже представлено фото с названиями аминокислот и структурными формулами:
Вот еще список аминокислот с молекулярными формулами в виде таблицы:
Глутамин
Нужен в белках для роста и поддержки мышц. Также является «топливом» головного мозга. Кроме того, глутамин выводит из печени все то, что поступает туда с нездоровой пищей. При термической обработке кислота денатурирует, поэтому, чтобы ее восполнить, нужно употреблять петрушку и шпинат в сыром виде.
Гистидин
Является важным строительным элементом всех внутренних органов. Играет едва ли не ключевую роль в образовании красных и белых кровяных телец. Положительно влияет на иммунную систему и половую функцию. Из-за широкого спектра применения, запасы гистидина в организме быстро истощаются. Поэтому важно принимать его с пищей. Содержится в мясных, молочных и злаковых продуктах.
Виды и задачи белка
Белок покрывает различные задачи в организме, его роль зависит от типа структуры:
- миозин является одним из основных составных частей для роста мышц. Характерной особенностью миозина является участие в нормальной жизнедеятельности сердечной мышцы и системы пищеварения. При употреблении в достаточном количестве нормализуется течение крови;

Что такое белок
- коллаген – это важнейшие белки, состоящие из аминокислот, которые оказывают активное влияние на строение костей, обеспечивая гибкость и прочность костных структур;
- другим важным белком является креатин, его первостепенная задача заключается в обеспечении иммунной защиты и повышении устойчивости к внешним негативным влияниям: высокие или низкие температуры, раны, облучение УФ, попадание инфекции.
Каждый фрагмент белка имеет в своем составе аминокислоты и 4 ключевых компонента: азот, водород, углерод и кислород. Практически не уступает по важности фосфор с серой.
Белки разделяются на 2 категории в зависимости от скорости действия в организме:
- быстрые – это сывороточный протеин, организм получает его из молока и продуктов из него. Характеристика белка заключается в быстром процессе переваривания и разделения на аминокислотный состав белков. После употребления подобного белка заметно быстрее формируется мышечная масса, после занятий организм восстанавливается значительно быстрее, активно пополняется энергетический состав и подпитываются участки строительным материалом;
- медленные белки состоят из более сложных соединений, которые обрабатываются организмом за более длительное время. Чаще они имеют пролонгированное действие на протяжении 6–8 часов. Представителями группы медленных белков является соевый вид и казеин. Их используют спортсмены для подавления катаболизма и устранения излишнего количества жировых отложений.
Организм одинаково нуждается в обоих типах белков, иначе могут развиться последствия дефицита. Обычному человеку, не занимающемуся спортом или тяжёлой работой, достаточно 1 г на 1 кг массы. Если человек испытывает интенсивные нагрузки, дозировку следует увеличивать в 2–3 раза.
Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
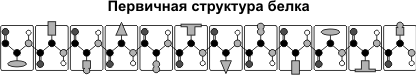
Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
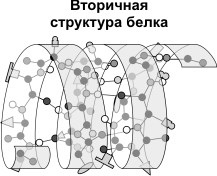
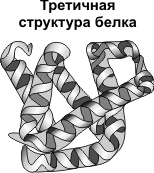
Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
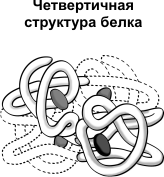
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
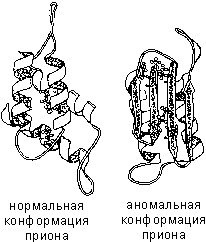
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
Причины дефицита аминокислот
Даже при современном уровне доступности любой информации продолжает существовать заблуждение о том, что весь набор аминокислот можно получить только из пищи животного происхождения. На самом деле, аминокарбоновые кислоты синтезируется и в растениях. Но биодоступность (усвояемость) таких АМК немного ниже, чем их продуктов животного происхождения.
Вегетарианство. Людям, придерживающимся принципов веганства, следует более тщательно контролировать свой рацион, чтобы гарантированно получать из пищи незаменимые аминокислоты.
Высокие нагрузки. Еще одна группа риска — люди, подвергающиеся чрезмерным физическим или психическим нагрузкам. При таких обстоятельствах расход аминокислот существенно выше, так как им приходится восстанавливать клеточные и тканевые ресурсы, израсходованные во время тренировок или стресса.
Некоторые заболевания. Они также могут быть причиной дефицита аминокислот. В частности, нарушения всасывания питательных веществ, при которых определенные вещества, потребляемые вместе с пищей, проходят через организм «транзитом» и неспособны принять участие в синтезе аминокислот или восполнении их дефицита.
Аминокислоты и их значение для человеческого организма
Говоря об аминокислотах, важно рассмотреть понятие незаменимости. Основной критерий определения биологической ценности аминокислоты — это способность поддерживать рост человека, что, в свою очередь, связано с синтезом белка в живом организме.
Незаменимые аминокислоты — это такие кислоты, которые либо не синтезируются в организме, либо синтезируются со скоростью, недостаточной для обмена веществ и образования новых клеток и тканей.
Если исключить из рациона хотя бы одну из незаменимых аминокислот, это повлечет за собой задержку роста и снижение массы тела растущего организма.
К незаменимым аминокислотам относятся валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
Заменимые аминокислоты — это те, которые организм может синтезировать самостоятельно или получить с продуктами питания. К ним относятся:
| аланин | глицин | серин |
| аргинин | глютамин | таурин |
| аспарагин | инозитол | тирозин |
| аспартат | орнитин | цистеин |
| гистидин | пролин | цитруллин |
Давайте рассмотрим основные функции некоторых аминокислот в организме человека, чтобы лучше понять их значение:
-
аспартат используется для процессов регенерации;
-
гистидин необходим маленьким детям, у которых недостаточен эндогенный синтез;
-
глютамин нужен для регенерационных процессов, важный энергетический субстрат в критических состояниях;
-
таурин нужен новорожденным, у которых недостаточен эндогенный синтез, а также больным в критических состояниях. Дефицит таурина возникает при недостатке метионина и цистеина;
-
тирозин необходим маленьким детям, у которых недостаточен эндогенный синтез. При нарушении функции почек снижено образование тирозина из фенилаланина;
-
цистеин необходим маленьким детям, у которых недостаточен эндогенный синтез. Дефицит цистеина возникает при недостаточном содержании метионина в питании. Необходим при нарушениях функции печени, а также больным в критических состояниях.
Глютаминовая кислота
Является важным элементом для здоровой работы головного и спинного мозга. Часто продается в виде добавки «Глутамат натрия». Встречается в яйцах, мясе, молочных продуктах, рыбе, моркови, кукурузе, помидорах и шпинате.
Треонин
Стремясь узнать, сколько аминокислот входит в состав белка, ученные открыли такое вещество, как треонин, одним из последних. А ведь оно очень даже полезно для человека. Треонин отвечает за все важнейшие системы человеческого организма, а именно за нервную, иммунную и сердечно-сосудистую. Первый признак его недостатка – проблемы с зубами и костями. Больше всего треонина человек получает из молочных продуктов, мяса, грибов, овощей и злаков.
Классификация, изомерия и номенклатура
Аминокислоты природного происхождения классифицируют на следующие группы:
Источник: chemege.ru
Общая классификация аминокислот:
Источник: chemege.ru
По содержанию функциональных групп, выделяют следующие типы аминокислот.
Нейтральная аминокислота — аминокислота, которая включает в себя лишь одну амино- и одну карбоксильную группу (моноаминомонокарбоновая кислота).
Основная или кислая аминокислота — аминокислота с дополнительными амино- или карбоксильными группами, например, моноаминодикарбоновые (содержат 1 амино- и 2 карбоксильных группы), диаминомонокарбоновые (содержат 2 амино- и 1 карбоксильную группу).
Следующая классификация аминокислот учитывает полярность и заряд молекул, что определят их склонность к взаимодействию с молекулами воды, т. е. гидрофильность или гидрофобность. В соответствии с таким принципом выделяют несколько классов соединений:
- неполярные (гидрофобные);
- полярные (гидрофильные) незаряженные;
- отрицательно заряженные;
- положительно заряженные при физиологических значениях pH.
Каждое соединение обладает тривиальным, то есть традиционным наименованием. В определенных случаях название обусловлено источником выделения. К примеру, аспарагин впервые был обнаружен в аспарагусе (спарже), глутаминовая кислота извлечена из клейковины (от англ. gluten — глютен) пшеницы, глицин получил свое название из-за сладкого вкуса (от греч. glykys — сладкий).
Природные α-аминокислоты R-CH(NH2)COOH имеют тривиальные названия, например:
- глицин;
- аланин;
- серин.
По правилам систематической номенклатуры, названия аминокислот образуются на основе наименований соответствующих карбоновых кислот путем добавления приставки амино- и уточнения положения аминогруппы относительно карбоксильной группы:
- 2–Аминобутановая кислота
- 3-Аминобутановая кислота
Согласно альтернативному методу называния аминокислот, тривиальное наименование карбоновой кислоты дополняют приставкой амино- с уточнением расположения аминогруппы с помощью буквы из греческого алфавита:
- α-Аминомасляная кислота
- β -Аминомасляная кислота
При использовании для указания положения аминогруппы букв греческого алфавита α-положением считается атом углерода, следующий сразу за карбоксильной группой.
Аминопентановая кислота или 4-аминопентановая кислота (ИЮПАК):
Согласно номенклатуре ИЮПАК, греческие буквы не применяют. Название аминокислот формируется по общему принципу, нумерация начинается с атома углерода карбоксильной группы, он считается первым. Наиболее важные аминокислоты обладают специальными названиями и обозначениями:
Источник: foxford.ru
Виды изомерии, характерные для аминокислот:
- Изомерия углеродного скелета
- Изомерия положения функциональных групп
- Пространственная (оптическая) изомерия.
Только для самой простой по структуре аминокислоты глицина не характерно наличие оптических изомеров. Остальные соединения содержат атомы углерода в α положении, окруженные четырьмя различными заместителями. По этой причине α-углеродный атом всех аминокислот, кроме глицина, представляет собой асимметрический центр. Данный факт объясняет существование аминокислот в форме двух стереоизомеров и их оптическую активность. Молекулы стереоизомеров в данном случае являются зеркальными отражениями друг друга.
Источник: foxford.ru
Оптическая изомерия природных аминокислот имеет большое значение для процессов биосинтеза белка. Молекулы белков высших организмов состоят из строго определенных стереоизомеров аминокислот — L-аминокислот, α-углеродный атом которых соответствует по своей абсолютной конфигурации углеродному атому L-глицеральдегида.
Существует несколько способов получения аминокислот:
- Замещение галогена аминогруппой в соответствующих галогензамещенных карбоновых кислотах
- Восстановление нитрозамещенных карбоновых кислот (применяется с целью синтеза ароматических аминокислот)
Роль аминокислот в организме
Когда речь заходит о белке в организме человека, с ним ассоциируют набор мышечной массы. Соответственно, белок рассматривают в качестве «топлива» для мышц. Но это лишь одна из функций протеина, который в теле человека представлен огромным разнообразием. Белок — это комплекс аминокислот, соединенных между собой пептидами. В зависимости от того, как АМК распределены в молекуле протеина и каким образом они соединены, меняется структура белка, его функции и другие характеристики. Возможно, кого-то это удивит, но под протеинами следует понимать не только «кирпичики» для набора мышечной массы, но и:
- коллаген — естественный «каркас», обеспечивающий упругость кожи, входящий в состав хрящевой ткани и пр.;
- нейромедиаторы — соединения, которые обеспечивают правильную интерпретацию нервных сигналов и их передачу между всеми органами и тканями;
- гормоны — вещества, регулирующие все функции организма: от работы репродуктивной системы до психических реакций.
Этот список можно еще продолжать.

Лейцин
Эта кислота отвечает за восстановление и защиту мышечных тканей, кожных покровов и костей. Именно благодаря лейцину выделяется гормон роста. Кроме того, эта органическая кислота регулирует уровень сахара в крови и способствует сжиганию жиров. Она содержится в мясе, орехах, бобовых, нешлифованном рисе и зернах пшеницы. Лецитин стимулирует синтез белка, а значит, способствует наращиванию мышечной массы.
Метионин
Мало кто знает, сколько аминокислот входит в состав белка, зато многим известно, что метионин активно сжигает жировые ткани. Но это далеко не все полезные свойства данной кислоты. Она влияет на выносливость и работоспособность человека. Если ее в организме недостаточно, это сразу можно понять по коже и ногтям. Метионин встречается в таких продуктах питания, как: мясо, рыба, семена подсолнечника, бобовые, лук, чеснок и кисломолочные продукты.
Аргинин
Говоря о том, сколько протеиногенных аминокислот входит в состав белков и какие функции они выполняют, мы убедились в том, что каждая из них важна для организма. Однако есть кислоты, которые, по мнению экспертов, считаются наиболее значимыми. К таковым относится аргинин. Он отвечает за здоровую работу мышц, суставов, кожного покрова и печени, а также укрепляет иммунитет и сжигает жиры. Аргинин часто используют бодибилдеры и те, кто желает похудеть, в составе добавок. В природном виде он встречается в мясе, орехах, молоке, злаках и желатине.

